
08. 이상기체
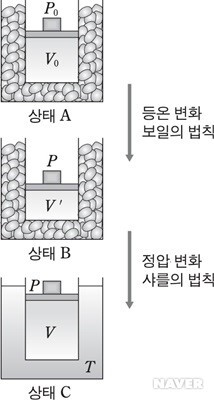
보일-샤를의 법칙
- 온도가 일정할 때 기체의 압력은 부피에 반비례한다는 보일의 법칙과 압력이 일정할때 기체의 부피는 온도의 증가에 비례한다는 샤를의 법칙을 조합하여 만든 법칙으로 온도, 압력, 부피가 동시에 변화할 때 이들 사이의 관계를 나타낸다.
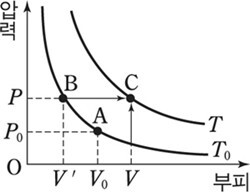
압력과 부피와 온도가 각각 P0, V0, T0인 기체를 압력을 P0로 일정하게 유지하면서 온도를 T로 변화시켰을 때 부피를 V’이라고 하면 샤를의 법칙에 의하여 다음과 같은 관계가 성립한다.
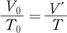
이번에는 온도를 T로 일정하게 유지하면서 압력을 P0에서 P로 변화시켰을 때 부피를 V라고 하면 보일의 법칙에 따라 다음의 관계가 성립한다.
P0V’=PV
위 두 식을 좌변은 좌변끼리 우변은 우변끼리 서로 곱하면 다음과 같이 된다.
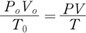
즉,
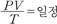
이것을 보일-샤를의 법칙이라고 한다.
아보가드로의 법칙
기체를 이해하기 위해 17세기 영국계 아일랜드인인 보일(Robert Boyle)은 기체의 압력과 부피와의 관계를, 샤를(Jacques Charles)과 게이뤼삭(Gay-Lussac)은 기체의 온도와 부피와의 관계를 설명하였다. 그후 이탈리아 과학자 아보가드로(Amedeo Avogadro 1776~1856)는 게이뤼삭이 주장한 기체반응의 법칙을 설명하기 위해 새로운 가설을 제안하였다.
아보가드로는 0℃, 1기압에서 여러 가지 기체의 1mol(몰) 당 부피를 측정한 결과 기체의 종류와 무관하게 몰부피가 매우 비슷함을 알아냈다. 이러한 결과로부터, '같은 온도와 압력 하에서 기체의 종류에 관계없이 같은 부피 속에는 같은 수의 분자가 들어 있다'는 아보가드로의 가설을 발표하였다. 모든 기체의 1mol은 똑같은 수의 분자를 포함한다는 것이다. 즉, 기체 분자들은 화학적, 물리적 특성과는 무관하게 같은 온도와 압력에서 기체 시료가 차지하는 부피는 기체의 mol수(분자 수)에 비례한다. 분자의 mol수(분자 수)를 2배하면 부피도 2배가 된다는 것이다.

이상기체의 가정
- 이상기체법칙을 따르는 기체로 구성분자들이 모두 동일하며 분자의 부피가 0이고, 분자간 상호작용이 없는 가상적인 기체이다. 실제의 기체들은 충분히 낮은 압력과 높은 온도에서 이상기체와 거의 유사한 성질을 나타낸다.
이상기체는 임의 온도와 압력 아래에서 다음 가정들로부터 유도되는 관계를 따른다.
1. 어떤 한 기체는 많은 동일한 분자들로 구성된다. '많다'라는 표현은 개개의 분자들의 경로를 추적할 수 없다는 것을 의미한다.
2. 분자들은 뉴턴의 운동법칙을 따른다.
3. 분자 자체만의 총 부피는 기체 전체가 차지하는 부피 중에서 무시할 수 있을 만큼 작은 부분이다. 즉, 분자 자체의 부피는 무시한다.
4. 모든 분자의 운동은 무작위적(random)이다. 즉, 각각의 분자들은 각각의 운동방향과 속력을 가지고 운동한다.
5. 분자들은 서로 상호작용하지 않으며, 분자와 용기 벽면의 충돌은 완전탄성충돌이라 가정한다.
이상기체 상태방정식
- 계산식
이상기체법칙은 다음과 같으며, 이상기체는 이상기체 법칙을 따른다.
PV = nRT
여기서 P는 압력, V는 부피, n은 기체의 몰수, R은 기체상수로서 8.3145J·mol-1·K-1, T는 절대온도이다.

'◎ [소방설비기사 자격증 공부] > -소방유체역학(기계)' 카테고리의 다른 글
| [소방유체역학] 정수역학-02.압력 (0) | 2022.09.29 |
|---|---|
| [소방유체역학] 정수역학-01.정수역학의 개념 (0) | 2022.09.29 |
| [소방유체역학] 유체이론-07.유체의 점성 (0) | 2022.09.28 |
| [소방유체역학] 유체이론-06.점성 (0) | 2022.09.27 |
| [소방유체역학] 유체이론-05.표면장력과 모세관 현상 (0) | 2022.09.26 |




댓글